Работа вышла в журнале Nature Chemical Biology и выполнена исследователями KAIST под руководством профессора Вон До Хо. Команда представила метод точечного ацетилирования РНК — химического изменения, которое не затрагивает саму последовательность нуклеотидов, но влияет на функции молекулы.
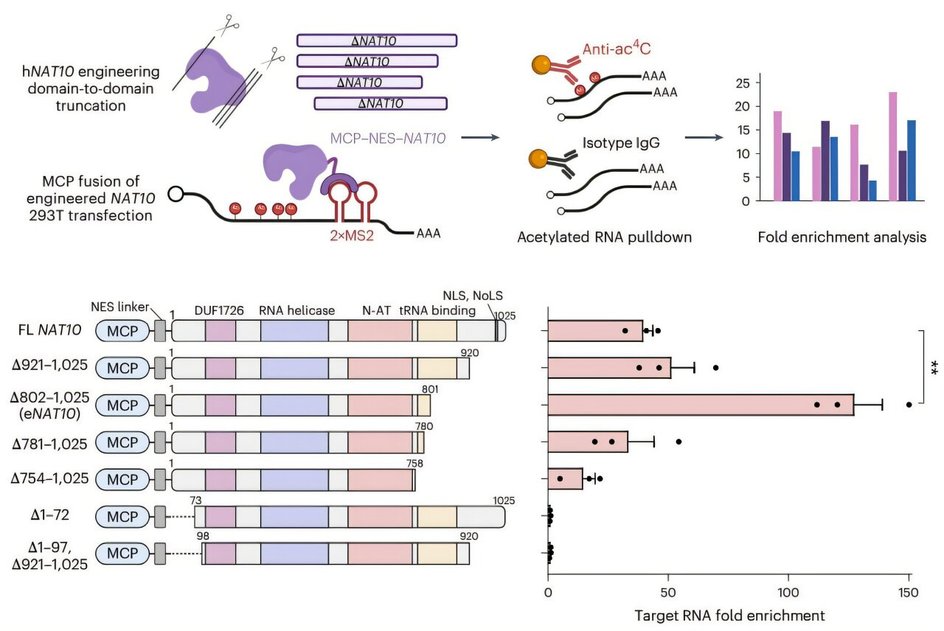
Речь идет о применении системы CRISPR-Cas13, так называемых «ножниц РНК», в связке с ферментом NAT10, способным модифицировать цитидин — один из строительных блоков РНК. Новый вариант фермента, eNAT10, усиливает этот процесс. Такая связка позволяет точно воздействовать на нужную молекулу РНК и изменять ее свойства, не затрагивая другие.
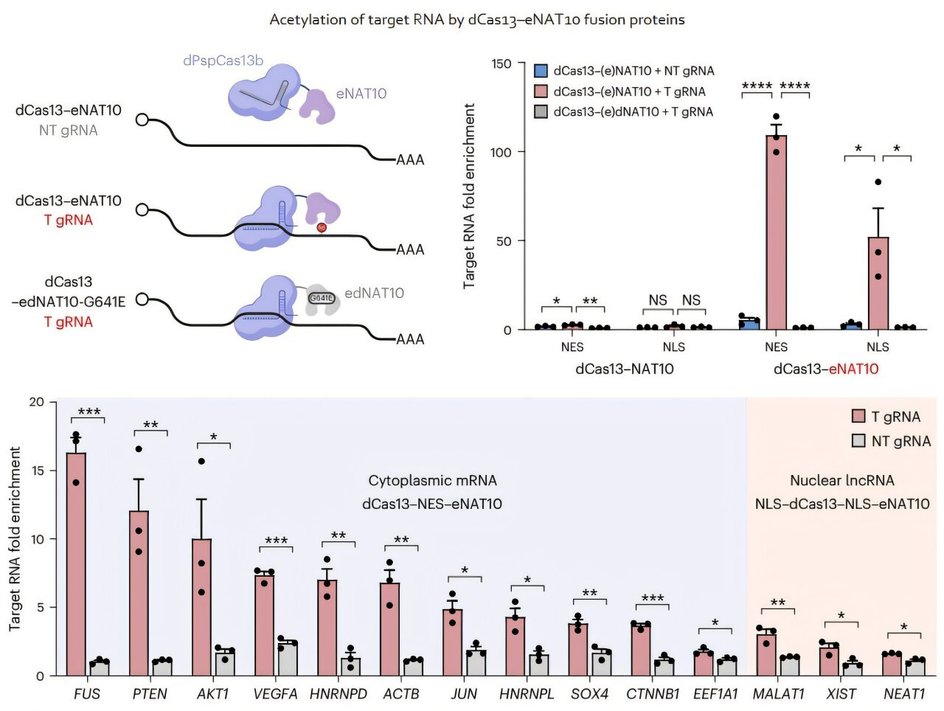
Авторы показали, что такая модификация повышает продукцию белка в клетке и помогает РНК быстрее покидать ядро, перемещаясь в цитоплазму — область, где происходит синтез белков. Это открывает возможность не только регулировать активность генов, но и влиять на путь, который РНК проходит внутри клетки.
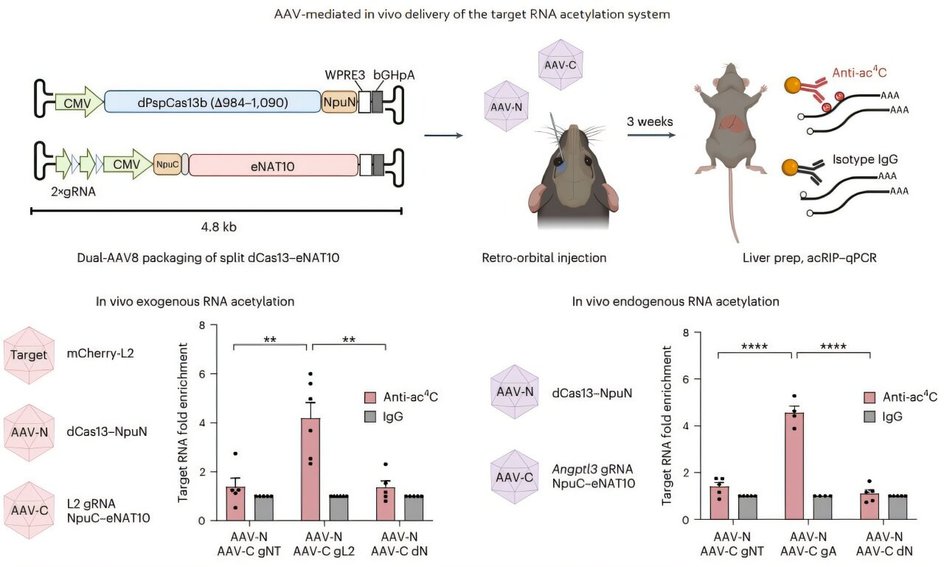
Более того, технология успешно протестирована in vivo, то есть внутри живого организма. С помощью вирусного вектора AAV, часто используемого в генной терапии, систему ввели в печень мышей. Результаты показали точное и избирательное воздействие на РНК в живых тканях.
Ранее профессор Вон До Хо разрабатывал методы терапии COVID-19 на основе тех же молекулярных ножниц и систему, активируемую светом. Новая технология отличается высоким уровнем контроля и универсальностью, делая ее потенциальным инструментом для лечения различных заболеваний, включая генетические и нейродегенеративные.
Если наука учится точно нацеливаться на молекулы внутри клеток, то другой недавний прорыв показал, как можно «сломать» защиту раковых клеток, делая их уязвимыми к лечению. Ранее Наука Mail рассказала о новой стратегии борьбы с лимфомой, где отключение важного фермента может стать ключом к победе над этой сложной болезнью.
