Туберкулез, вызываемый Mycobacterium tuberculosis, ежегодно уносит жизни 1,3 миллиона человек, оставаясь второй по смертности инфекцией после COVID-19. Сложные схемы лечения и рост устойчивости к антибиотикам делают поиск новых мишеней особенно важным. Исследователи из Университета Бат обратили внимание на фермент α-метилацил-КоА рацемазу (MCR), с помощью которого бактерия расщепляет холестерин и получает энергию в организме человека.
По данным статьи, опубликованной в журнале Journal of Biological Chemistry, ученые определили трехмерную структуру MCR и описали, как она взаимодействует с различными веществами. Им удалось выделить 12 соединений из двух химических семейств, которые связываются с этим ферментом и подавляют его активность.
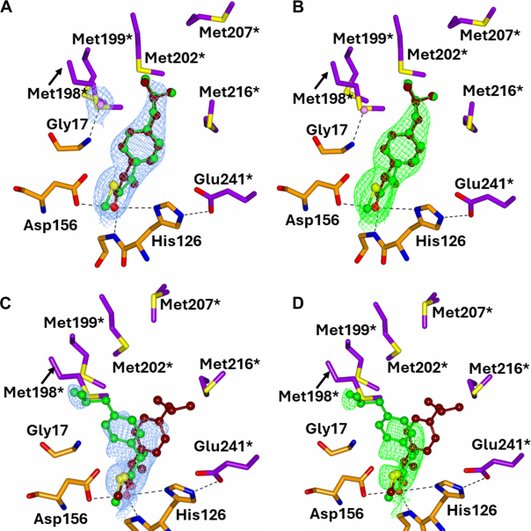
С помощью рентгеновской кристаллографии команда расшифровала высокоточные структуры фермента в комплексе с каждым из этих соединений. Это позволило установить, какие именно аминокислоты участвуют в связывании, и как можно усилить эффект. MCR оказался особенно чувствительным к производным ибупрофена и его аналогам. Эти данные закладывают основу для создания новых препаратов, которые будут блокировать метаболизм бактерии и лишать ее главного источника питания.
Интересно, что эти же соединения связаны с человеческим аналогом фермента — AMACR, который считается перспективной мишенью при лечении рака простаты. Хотя структура AMACR пока полностью не расшифрована, результаты с MCR помогают понять, как работает и человеческий фермент.
Исследование не только раскрывает работу одного из важных ферментов туберкулезной палочки, но и демонстрирует стратегию разработки лекарств на основе структурной информации. Поскольку соединения, блокирующие MCR, не соответствуют фармакологическим «правилам Липинского» и плохо всасываются, их потребуется модифицировать под форму «пролекарств» или использовать в виде производных, подходящих для терапии. Команда уже работает над этим направлением.
Ранее мы писали, как ИИ анализирует рентгеновские снимки.
