
Частицы вещества находятся в состоянии постоянного движения: они колеблются, вращаются и перемещаются, причем с ростом температуры их скорость увеличивается. Все эти процессы и их следствия подробно описывает молекулярно-кинетическая теория. Рассмотрим ее ключевые постулаты, основные понятия и принципы, а также выясним, как она применяется в современной науке.
Что такое молекулярно-кинетическая теория
Молекулярно-кинетическая теория рассматривает свойства веществ, исходя из представления об их молекулярной структуре. В рамках МКТ все макроскопические явления — давление, температура, изменение агрегатных состояний — объясняются движением и взаимодействием молекул и атомов.
Основы молекулярно-кинетической теории получили убедительные экспериментальные подтверждения и стали фундаментом некоторых разделов современной физики, а именно физической кинетики и статистической механики.
Основные положения молекулярно-кинетической теории
В основу МКТ входят три постулата. Это основные положения о свойствах веществ.
Постулат 1
Все вещества состоят из мельчайших частиц — атомов и молекул.
Классическое подтверждение первого постулата — явление диффузии: смешения молекул или атомов на границе контакта двух тел. К примеру, распространение ароматов в воздухе — это диффузия газов, а растворение сахара в чае — диффузия твердых и жидких тел. Если бы тела были монолитны, подобного взаимного проникновения не происходило бы.
Постулат 2
Частицы вещества находятся в постоянном хаотическом движении. Оно усиливается с повышением температуры, поэтому его называют тепловым. Даже без внешнего воздействия молекулы не останавливаются, а их траектория постоянно меняется из-за случайных столкновений друг с другом.
«Убедиться в этом можно, рассматривая броуновское движение — перемещение мельчайших твердых частиц в жидкости, — комментирует Валерий Тепляков. — С точки зрения законов механики, такое движение противоестественно, ведь эти частицы должны были бы тормозиться вязким трением со стороны среды. Однако образ движения зависит в первую очередь от температуры и обусловлен не механическими, а молекулярно-кинетическими законами».
Постулат 3
Атомы и молекулы взаимодействуют между собой.
«Подтверждение этому в характере изменений вещества при фазовых переходах, — поясняет Валерий Тепляков. — К примеру, вода, переходя при кипении из жидкого состояния в газообразное, сохраняет свой химический состав. Однако ее физические свойства разительно трансформируются: меняются расстояния между частицами, интенсивность взаимодействия между молекулами и т.д».
Основные понятия и термины МКТ
Рассмотрим ключевые понятия МКТ.
Молекула
Молекула — это мельчайшая частица вещества, сохраняющая все его химические свойства. Она состоит из атомных ядер, внутренних электронов и валентных электронов, которые образуют химические связи между атомами.
Тепловое движение
Тепловое движение — это беспорядочное перемещение частиц вещества. Скорость движения этих частиц зависит от температуры.
Диффузия
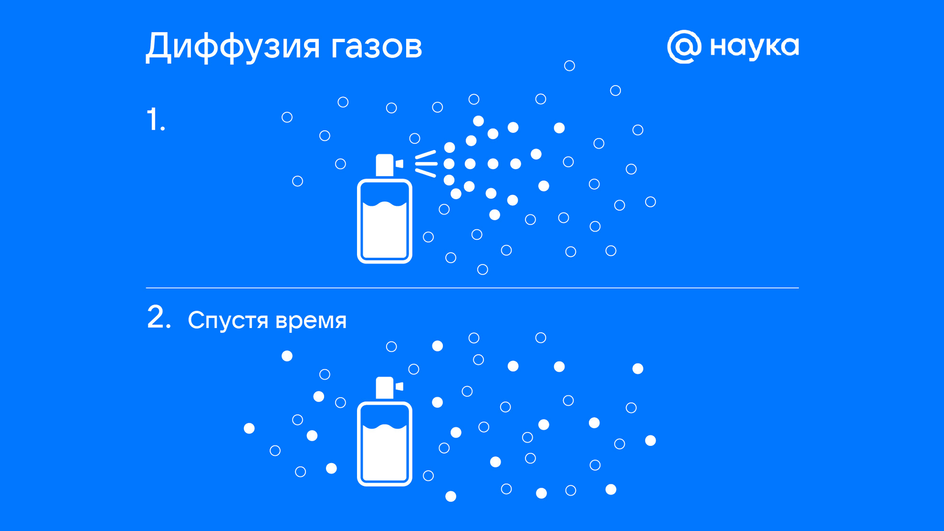
Диффузия — процесс взаимного проникновения молекул одного вещества между молекулами другого на границе контакта. При этом перемещение частиц происходит из области с высокой концентрацией в область с низкой концентрацией, а скорость протекания диффузии зависит от температуры тел и их агрегатного состояния.

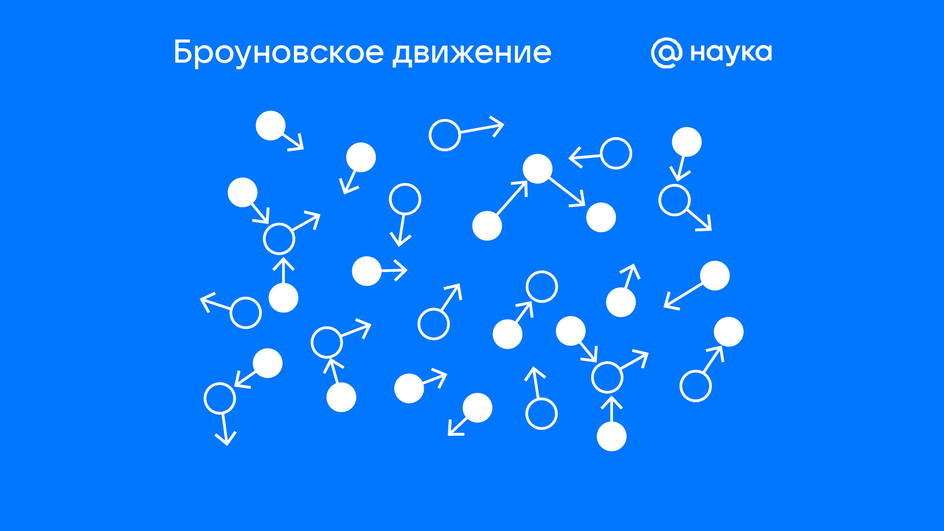
Броуновское движение
Броуновское движение — это хаотичное перемещение микроскопических частиц, взвешенных в жидкости или газе. Это наглядное подтверждение второго постулата МКТ.
Средняя кинетическая энергия
Средняя кинетическая энергия частиц — это энергия теплового движения всех молекул или атомов в веществе, рассчитанная путем усреднения по скоростям. Она напрямую зависит от температуры и для одноатомных газов (аргона, неона и т.д.) определяется по следующей формуле:

Молекулярно-кинетическая теория газов
Многие принципы молекулярно-кинетической теории были сформулированы на основе изучения газов. Они представляют собой наиболее простую для анализа термодинамическую систему. Поэтому для упрощения расчетов и вывода формул в МКТ используют теоретическую модель идеального газа.
Применение теории к идеальному газу
Молекулярно-кинетическая теория рассматривает частицы такого вещества как материальные точки: пренебрегает их объемом, но при этом учитывает их ненулевую массу. В рамках этой модели предполагается, что молекулы и атомы находятся в состоянии непрерывного хаотического движения, и их взаимодействие ограничивается моментами кратковременных столкновений — как между собой, так и со стенками сосуда. Именно эти многочисленные соударения и создают то самое давление газа, которое мы можем измерить.
Как МКТ объясняет газовые законы
Газовые законы отображают связь между давлением, температурой и объемом.
1. Закон Бойля — Мариотта

Объяснение с точки зрения МКТ: если сжать газ (уменьшить объем — V), концентрация молекул вырастет, значит, удары о стенки участятся, следовательно, давление (p) увеличится. Если же увеличить объем, концентрация молекул снизится, удары о стенки сосудов станут реже, и давление уменьшится.
2. Закон Шарля

Объяснение с точки зрения МКТ: если нагреть газ в жестком сосуде, молекулы начнут двигаться быстрее. Значит, они начнут ударяться сильнее о стенки сосуда. Следовательно, давление вырастет. И наоборот: при охлаждении газа молекулы начнут двигаться медленнее, удары о стенки станут менее сильными, значит — давление снизится.
3. Закон Гей-Люссака

Объяснение с точки зрения МКТ: если нагреть газ при постоянном давлении, молекулы, разгоняясь, будут расширять стенки. Значит, объем увеличится. Если охлаждать газ при постоянном давлении, молекулы начинают двигаться медленнее, а их удары о стенки сосуда становятся слабее. Чтобы поддерживать прежнее давление, газ должен уменьшить свой объем.
4. Закон Менделеева — Клапейрона
Объединив все эти идеи, МКТ приводит нас к универсальному уравнению состояния идеального газа.

В работе «Общий курс физики. Термодинамика и молекулярная физика» Дмитрий Сивухин пишет, что это уравнение отражает зависимость между давлением — то есть, результатом ударов молекул о стенки сосуда, объемом — пространством, в котором движутся частицы, и температурой — мерой средней кинетической энергии молекул.
Основная задача молекулярно-кинетической теории
Основная задача молекулярно-кинетической теории — объяснить макроскопические свойства (давление, температура и т.д.) веществ и протекающие в них процессы (теплообмен, диффузия и др.) через законы движения и взаимодействия их частиц — атомов, молекул, ионов.
Значение и применение МКТ в современной науке

Комментирует биофизик Валерий Тепляков:
«МКТ — один из краеугольных камней классической физики. Применение формул и закономерностей этого раздела в науке и промышленности повсеместно. К примеру, знания этой направленности необходимы при проектировании криогенной и вакуумной техники, при расчетах холодильных, обогревательных и тепловентиляционных систем или при исследованиях в ускорителях или ядерных реакторах».
Молекулярно-кинетическая теория кратко: шпаргалка
1. МКТ — теория, объясняющая макроскопические свойства веществ через движение и взаимодействие атомов и молекул.
2. Три постулата МКТ:
- вещества состоят из атомов и молекул;
- частицы находятся в постоянном хаотическом движении;
- между частицами происходит взаимодействие.
3. Тепловое движение — беспорядочное движение частиц, усиливающееся с ростом температуры.
4. Диффузия — процесс взаимного проникновения молекул одного вещества между молекулами другого вещества в области их контакта.
5. Броуновское движение — хаотичное перемещение мельчайших твердых частиц в жидкости или газе.
6. Средняя кинетическая энергия зависит от температуры и для одноатомных газов.
7. МКТ объясняет газовые законы через связь между давлением, температурой и объемом по закону Бойля — Мариотта, закону Шарля, закону Гей-Люссака и закону Менделеева — Клапейрона.
8. МКТ применяется повсеместно: в криогенной технике, термодинамике, ядерных исследованиях и промышленности.




