
В статье расскажем, что такое кристаллическая решетка, каких видов она бывает и как эта невидимая архитектура определяет характеристики разных веществ ― от алмаза до йода.
Что такое кристаллическая решетка
Кристаллическая решетка — это упорядоченная структура, в которой частицы (атомы, ионы, молекулы) расположены в строгом геометрическом порядке. Такая организация обеспечивает стабильность вещества. Например, алмаз и графит состоят из углерода, но из-за разного строения решетки один может царапать стекло, а другой настолько хрупкий, что пишет на бумаге.
О том, какими бывают кристаллические решетки, рассказал младший научный сотрудник Всероссийского НИИ автоматики имени Н. Л. Духова Алексей Грачков:
«Кристаллические решетки являются основным источником свойств твердых тел. В зависимости от типа связи атомы могут выстраиваться в разные симметричные фигуры — кристаллические упаковки. В зависимости от вида упаковки, будь то кубическая, октаэдральная или другая, меняются механические и тепловые характеристики. Та же форма кристаллической решетки влияет на электронные оболочки атомов, позволяя электронам с внешних уровней быть более свободными (в случае металлов), образуя электрические и магнитные свойства вещества».

Интересно, что не все твердые тела кристаллические. Стекло или угольная сажа — аморфны: их частицы расположены хаотично, а не упорядоченно. Они не имеют четкой температуры плавления, поэтому при нагревании постепенно размягчаются. А кроме того, изотропны — их свойства (механические, оптические, электрические и другие) не зависят от направления.
История открытия кристаллических решеток
Прежде чем кристаллические решетки были открыты, научному сообществу предстояло доказать атомное строение веществ. Первые экспериментальные доказательства появились лишь в начале XIX века благодаря работам естествоиспытателя, физика и химика Джона Дальтона.
Он заметил, что химические элементы соединяются в строгих пропорциях, что можно было объяснить только существованием мельчайших частиц. Позже исследования броуновского движения, открытие периодического закона Менделеева и развитие кинетической теории газов окончательно убедили ученых в реальности атомов.
Современным школьникам хорошо известно, что все вещества состоят из атомов. Однако путь к этому знанию был долгим и сложным. Основная трудность заключалась в чрезвычайно малых размерах атомов. Для наглядности: если увеличить атом до размера точки (около 0,5 мм), то человеческая голова достигла бы размеров земного шара.
После того, как научное сообщество убедилось, что все состоит из атомов, возник вопрос о расположении частиц в материалах. Еще в XVIII веке Михаил Ломоносов сформулировал основные положения молекулярно-кинетической теории, описывающей различия в строении твердых, жидких и газообразных веществ.
Следом французский минералог Рене Жюст Гаюи выдвинул гипотезу, что кристаллы состоят из повторяющихся структурных элементов. Дальнейшее развитие эта теория получила в работах Огюста Браве, который в 1848 году разработал теорию пространственных решеток и классифицировал 14 возможных типов. Окончательное экспериментальное подтверждение существования химических структур было получено в начале XX века благодаря работам Вильгельма Конрада Рентгена и Макса Лауэ.
Типы кристаллических решеток
По симметрии расположения решетки могут быть двухмерными и трехмерными (кубическими, гексагональными и др.), а по строению выделяют молекулярные, атомные, ионные и металлические.
Молекулярная решетка
Тип кристаллической структуры, в которой узлы заняты нейтральными молекулами, связанными между собой слабыми межмолекулярными силами. Благодаря такому взаимодействию частиц, вещества часто обладают низкими температурами плавления и кипения, а также высокой летучестью.
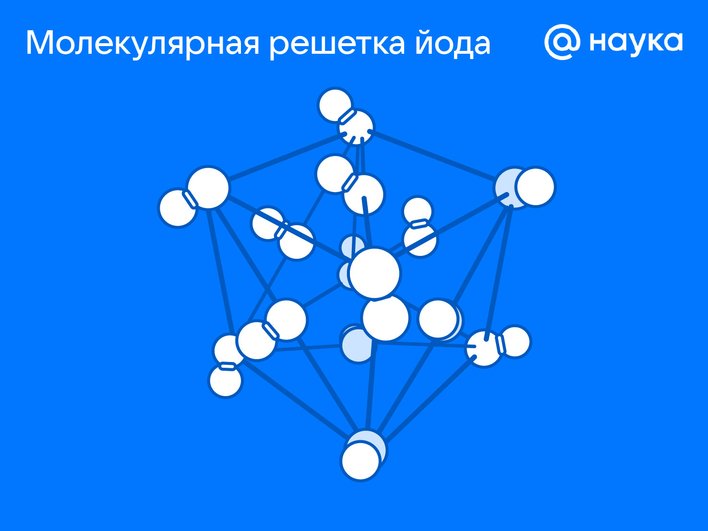
Строение
«Кирпичиками» служат целые молекулы, а между ними — слабые межмолекулярные силы (ван-дер-ваальсовые или водородные). Внутри молекул атомы, наоборот, соединены прочными ковалентными связями. Например, в кубике льда молекулы H₂O образуют ажурную решетку с пустотами, из-за чего лед легче воды.
Свойства
- Низкая прочность: связи между молекулами легко рвутся — достаточно подуть на йод, и он испаряется.
- Летучесть: такие вещества легко переходят в газообразное состояние.
- Диэлектрики: нет свободных зарядов для проведения тока.
Примеры веществ
Сахар, парафин, кислород, твердый метан (CH₄).
Атомная решетка
Кристаллическая структура, в которой узлы заняты отдельными атомами с прочными ковалентными связями. Это придает таким веществам высокую твердость и тугоплавкость.
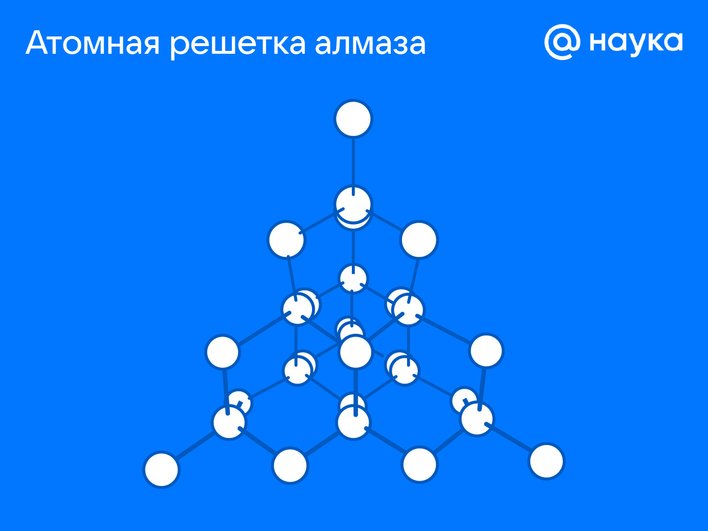
Строение
Атомы образуют гигантскую сеть. Например, в алмазе каждый атом углерода соединен с четырьмя соседями и создает тетраэдрическую структуру.
Интересно, но если поместить алмаз в условия высокой температуры и давления, то он превратится в графит, и наоборот. Обусловлено тем, что оба минерала состоят из одних и тех же атомов углерода, но собраны по-разному.
Свойства
- Тугоплавкость: кварц (SiO₂) плавится при 1713 — из него делают тигли для плавки металлов.
- Твердость: алмаз режет стекло, но хрупок — удар молотком разобьет его вдоль плоскостей решетки.
- Непроводимость: электроны прочно «заперты» в связях. Исключение — графит, где между слоями атомов перемещаются свободные электроны.
Примеры веществ
Алмаз, кремний, карборунд (SiC).
Ионная решетка
Структура, которая состоит из положительно и отрицательно заряженных ионов. Они удерживаются силами электростатического притяжения, что обеспечивает ее высокую прочность и тугоплавкость.

Строение
Чередование положительно и отрицательно заряженных ионов, расположенных в узлах кристаллической решетки и связанных между собой ионной связью. В поваренной соли, например, каждый ион натрия окружен шестью хлорид-ионами и образует кубическую решетку.
Свойства
- Хрупкость: сдвиг слоев приводит к встрече одноименных зарядов — и решетка разрушается. Если ударить молотком по кристаллу соли, то он превратится в порошок.
- Высокая температура плавления: хлорид натрия плавится при 801°C.
- Электропроводность присутствует только в растворе, где ионы подвижны. В твердом состоянии не проводят ток.
- Растворимость в воде: полярные молекулы H₂O «растаскивают» ионы на части.
Примеры веществ
Решетка характерна для большинства солей (например, NaCl), щелочей (КОН), оксидов металлов (СаО).
Любопытно, что ионные кристаллы могут быть цветными: например хлорид кобальта CoCl₂ — синий.
Металлическая решетка
В узлах этой кристаллической структуры находятся положительно заряженные ионы металлов, окруженные «электронным газом» из свободно движущихся валентных электронов, что обеспечивает высокую электропроводность и пластичность.

Строение
Состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Это похоже на пчелиные соты, где «пчелы» (электроны) свободно перемещаются, связывая ячейки.
Свойства
- Ковкость и пластичность: слои ионов не ломаются под нагрузкой — из золота можно выковать лист толщиной в 0,0001 мм.
- Теплопроводность: электроны переносят энергию — медная кастрюля быстро нагревается.
- Блеск: электроны отражают световые волны — полированное серебро сияет, как зеркало.
Примеры веществ
Все металлы и сплавы: медь, железо, алюминий и другие. Интересно, что галлий плавится в руке при температуре 29,8°C, но его решетка сохраняет металлические свойства даже в жидком состоянии.
Как определить кристаллическую решетку
Каждый тип обладает своими уникальными свойствами. По ним можно предсказать, как будет вести себя материал или вещество в определенных условиях.
- Металлическая: блестит, проводит ток, пластична (медная проволока гнется, а не ломается).
- Ионная: твердая, но вместе с тем хрупкая, растворяется в воде, проводит ток только в растворе.
- Атомная: очень твердая, не растворяется (алмаз не взаимодействует даже с кислотами).
- Молекулярная: низкая температура плавления, летучесть (кристаллы йода испаряются на воздухе).
Области применения кристаллических решеток
Знание о кристаллических решетках применяют в следующих областях
- Фармацевтика — создание лекарств с контролируемым высвобождением активного вещества путем модификации кристаллической структуры.
- Электроника — производство полупроводниковых устройств (транзисторов, микросхем), где критически важна структура кристаллов кремния.
- Ювелирное дело — огранка драгоценных камней с учетом их химического состава для максимального светопреломления.
- Нанотехнологии — создание материалов с уникальными свойствами (например, графен).
- Материаловедение — разработка новых функциональных материалов.
По словам эксперта Константина Барковеца, знание о пространственном расположении атомов позволяет ученым глубже понимать свойства твердых тел и создавать материалы с заданными характеристиками.
«Современные сверхпрочные сплавы и композитные материалы — яркое тому подтверждение. Например, крыло российского самолета МС-21 изготовлено из перспективных материалов нового поколения, разработанных с учетом особенностей атомной структуры вещества. Эти материалы обладают уникальными характеристиками, что делает МС-21 одним из самых современных лайнеров в мире».
Задачи по кристаллическим решеткам 8 класса
Предлагаем вам проверить полученные знания о кристаллических решетках на этих несложных задачах:
- Вещество А имеет температуру плавления 800°C, растворяется в воде, раствор проводит ток. Какая решетка у А?
- Почему алмаз и графит, состоящие из углерода, имеют разные свойства?
- Вещество Б плавится при −50°C, не проводит электрический ток ни в твердом, ни в жидком состоянии и легко испаряется при комнатной температуре. Какая кристаллическая решетка у вещества Б?
Ответы на задачи
1) У вещества А — ионная кристаллическая решетка.
- Высокая температура плавления (800°C) характерна для ионных, атомных и металлических решеток, но расщепление — только у ионной.
- Растворение в воде и электропроводность раствора указывают на диссоциацию на ионы (NaCl, KNO₃ и др.).
2) Почему алмаз и графит имеют разные свойства?
Алмаз и графит — модификации углерода с разными типами кристаллических решеток.
- Первый имеет атомную решетку, когда каждый атом углерода ковалентно связан с четырьмя другими. Он сверхтвердый, не проводит ток.
- Второй обладает решеткой, где атомы связаны ковалентно, а между слоями — слабыми ван-дер-ваальсовыми силами, поэтому он мягкий и проводит ток.
3) У вещества Б — молекулярная кристаллическая решетка.
- Низкая температура плавления (−50°C) говорит о слабых силах взаимодействия между частицами. Это характерно для молекулярных решеток.
- Отсутствие электропроводности означает, что в веществе нет свободных заряженных частиц (ионов или электронов). В молекулярных кристаллах электроны прочно связаны внутри молекул, поэтому ток не проводится.
- Легкая испаряемость при комнатной температуре (как у йода) тоже подтверждает, что связи между молекулами очень слабые.

Главное о кристаллических решетках
Кристаллические решетки играют ключевую роль в материаловедении, металлургии, электронике и даже биологии. Понимание их строения позволяет создавать новые материалы с заданными свойствами, например сверхпроводники.
- Тип решетки определяет свойства вещества.
- Выделяют четыре типа: молекулярная, атомная, ионная, металлическая.
- Металлы пластичные, ионные кристаллы хрупкие, атомные — самые твердые.
- Электропроводность есть у металлов и ионных растворов.
- Температура плавления: самая высокая у атомных, а самая низкая у молекулярных.





