
CRISPR‑Cas9 — это молекулярная система, открытая в бактериях и археях еще в 1987 году, однако использовать ее в конструктивных целях ученые научились лишь спустя десятилетия.
Для естественной защиты от вирусов клетки хранят в своих геномах фрагменты ДНК захватчиков и с помощью Cas‑фермента избавляются от угрозы. В 1990‑х годах испанский микробиолог Франсиско Мохика назвал эти необычные повторы «CRISPR», а затем — вместе с Эммануэль Карпентье и Дженнифер Доудной — адаптировал эту систему для целенаправленного разрезания ДНК уже в пробирке и клеточных культурах. В 2012 году они впервые объединили две РНК в одну направляющую (sgRNA), превратив Cas9 в универсальные «ножницы» для генома. Спустя всего несколько месяцев, уже в 2013 году, Фэн Чжан и другие продемонстрировали редактирование генов CRISPR‑Cas9 в человеческих клетках — и наука вошла в новую эру.
Но у этой революции есть теневая сторона.
Как ИИ спасает генную революцию?
Технология CRISPR-Cas9 стала прорывом в молекулярной биологии. «Молекулярные ножницы» позволяют вырезать и заменять участки ДНК, открывая путь к лечению десятков наследственных заболеваний, таких как серповидноклеточная анемия или бета-талассемия. Но за точечным редактированием скрываются риски. Одно из главных опасений — off-target эффекты: фермент Cas9 может случайно разрезать нецелевые участки ДНК, вызывая мутации с непредсказуемыми последствиями. Хотя масштабных трагедий в клиниках пока не зафиксировано, лабораторные исследования на животных показывают: такие ошибки способны активировать онкогены.
И даже если «разрез» точен, то починка ДНК часто идет не по плану. Наиболее распространенный механизм восстановления — NHEJ — склонен к ошибкам, а результат редактирования может не соответствовать задуманному. Именно поэтому эффективность терапии сильно варьируется: от 20% до 60% в зависимости от цели, ткани и метода доставки. Процесс выбора направляющих молекул (sgРНК), которые ведут ножницы к нужному участку, — это долгие итерации проб и ошибок. CRISPR долгое время оставался мощным, но ненадежным инструментом.
Именно здесь вступает в игру искусственный интеллект. Это не замена ученому, а его цифровой соратник. Нейросети анализируют миллиарды генетических паттернов, предсказывают потенциальные off-target сайты, оценивают структуру хроматина и моделируют процессы репарации. Алгоритмы позволяют создавать эффективные и безопасные «гиды» для CRISPR буквально за часы. Генетическое редактирование из экспериментального искусства превращается в инженерную дисциплину.
Интеграция ИИ и машинного обучения с редактированием генома CRISPR оказывает реальные эффекты уже сегодня — помогая находить редкие белки, устойчивые к нагреву РНК-молекулы и ускорять терапевтические открытия.
Благодаря синтезу биологии и алгоритмов, редактирование генов становится все более управляемым, а значит — безопасным. И это может стать поворотным моментом для всей медицины.
Как ИИ делает CRISPR точнее: три технологии, которые меняют генную инженерию
Представьте хирурга, который не только видит ДНК в 3D, но и заранее знает, как организм отреагирует на вмешательство. Именно такую роль сегодня берет на себя искусственный интеллект, усиливая инструменты генного редактирования.
Поиск ошибок до разреза: ИИ против off‑target‑эффектов
Одной из главных проблем CRISPR были «случайные» разрезы. Алгоритм DeepCRISPR использует машинное обучение, чтобы предсказывать вероятность таких ошибок, анализируя не только последовательность ДНК, но и эпигенетические метки. Он значительно точнее классических подходов и уже помогает в разработке терапий, например, при серповидноклеточной анемии — хотя пока не применяется в клиниках напрямую.
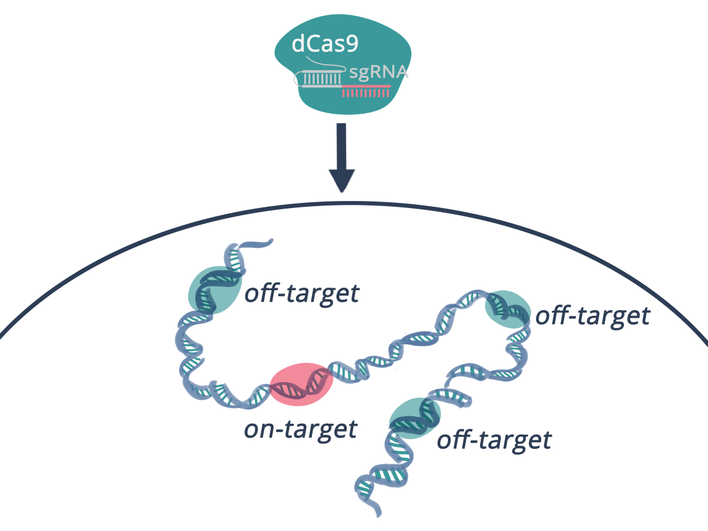
Искусственный интеллект позволяет нам предсказывать взаимодействия CRISPR с геномом на уровне, недоступном традиционным методам. Это значительно снижает риски off-target эффектов и ускоряет разработку безопасных терапий.
Как клетка «чинит» ДНК: inDelphi и прогноз последствий
Даже идеально выполненный разрез не гарантирует точного восстановления. Алгоритм inDelphi (MIT) предсказывает, как именно клетка отреагирует на вмешательство, моделируя вероятность мутаций (инделов) в зависимости от типа клеток и белков репарации. Например, в нейронах ошибка при восстановлении встречается чаще, чем в стволовых клетках. Эти прогнозы позволяют выбирать оптимальные версии Cas9 и повышать точность редактирования.
Интеграция ИИ в CRISPR‑процессы буквально трансформирует нашу способность быстро и надежно прогнозировать клеточные ответы на разрезы с особым усилением точности редактирования в разных типах клеток.
Умный выбор гидов: как CRISPick ускоряет дизайн
Платформа CRISPick от Broad Institute анализирует эффективность тысяч вариантов sgРНК и выбирает наилучшие на основе обширных биологических данных. Это существенно экономит время при проектировании экспериментов — вместо месяцев, нужных раньше на отбор, ученые получают рекомендации за часы.
Что дальше?
ИИ все глубже интегрируется в генную инженерию. Исследователи уже тестируют сочетание структурных моделей белков (например, AlphaFold) с CRISPR, разрабатывают новые ферменты, а этические платформы начинают оценивать потенциальные риски таких вмешательств. Редактирование генома постепенно становится цифровым процессом — от идеи до симуляции и исполнения.
AlphaFold 3 не просто предсказывает структуры белков — теперь он показывает, как они взаимодействуют с другими молекулами, включая ДНК. Это фундаментальный шаг вперед для дизайна нуклеаз будущего.
Из лабораторий к практике – реальные достижения CRISPR + ИИ
Теоретические выкладки важны, но настоящая ценность CRISPR + ИИ измеряется реальными успехами: клиническими терапиями и аграрными инновациями. Приводим обзор таких достижений с комментариями экспертов.
Рак: персонализированные CAR‑T под контролем ИИ
Сегодня CAR‑T‑терапии эффективны при некоторых видах лейкемии, но не всегда помогают при солидных опухолях. Исследователи используют ИИ (включая AlphaFold и GNN) для анализа опухолевых антигенов и подбора неоэпитопов, а CRISPR помогает точить Т‑клетки.
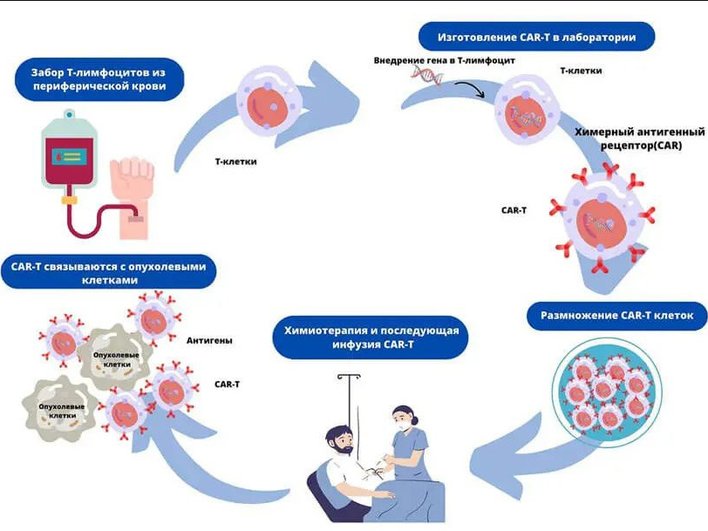
ИИ уже изменяет правила — он помогает быстро находить и использовать наши огромные геномные базы данных.
ВИЧ: CRISPR‑терапия EBT‑101 на приматах
Excision BioTherapeutics разработала EBT‑101 — in vivo терапию для удаления провируса HIV. В доклинических исследованиях на макаках (SIV-инфицированных) single-доза убирала провирусную ДНК и показывала хорошую биораспределенность без off-target эффектов. Сейчас препарат уже в клинической фазе.
Сельское хозяйство: повышение устойчивости культур
CRISPR уже применялся для повышения устойчивости растений к климатическому стрессу. Например, изменения в генах, регулируемых белками теплового шока (например, HSP), действительно показывали улучшение устойчивости при полевых испытаниях.
Клиника: наследственные болезни
Серповидноклеточная анемия: терапия exa‑cel (Casgevy) от Vertex + CRISPR Therapeutics получила FDA и EMA одобрение в декабре 2023, с отсутствием острых кризисов у 93.5% пациентов спустя год. В Великобритании терапия была одобрена в ноябре 2023 года, в США — в декабре 2023 года, а в Европейском союзе — в феврале 2024 года.
Exa‑cel остается мощным инструментом для лечения серповидноклеточной анемии: пациенты становятся независимыми от кризисов с высокой надежностью, при этом риск тяжелых осложнений возникает из‑за подготовительной химиотерапии, а не технологии редактирования.
ИИ направляет — CRISPR исполняет. Эта кооперация ускоряет решения, сдвигая сроки разработки терапий с лет до месяцев. Однако громкие исторические кейсы требуют объективной проверки, и мы продолжаем внимательно следить за данными.
Перспективы: куда движется CRISPR + ИИ?
Система CRISPR совместно с искусственным интеллектом — это не просто инструменты. Это целая революция. Она выходит далеко за пределы простого исправления генетических ошибок. Уже сейчас мы видим три мощных направления, которые к 2030 году могут полностью изменить медицину, сельское хозяйство и даже наше представление о жизни.

Первое направление — превентивная медицина. Представьте: берете геном новорожденного, пропускаете через умный алгоритм, и он предсказывает риск заболеть диабетом, раком или Альцгеймером. После этого с помощью безопасных методов редактирования, таких как prime editing, потенциальные болезни корректируются еще до того, как проявятся симптомы. Идея фантастическая? Так может показаться с первого взгляда. Но проекты с подобным подходом уже запускаются — например, в Китае и Европе.
Второе — это редактирование без разрезов. Классический CRISPR работает с ножницами, разрезая ДНК. А это всегда риск. Новые технологии предлагают «мягкое» вмешательство: меняют метилирование или регулируют активность генов без повреждения структуры. В экспериментах на мышах уже удалось значительно снизить проявления болезни Хантингтона без разрезания ДНК. Это большой шаг вперед.
Интеграция искусственного интеллекта в биотехнологическую отрасль кажется безграничной. Его сочетание с CRISPR может стать той областью, где ИИ имеет наибольший потенциал.
Третье — биоинженерия целых систем. Здесь CRISPR и ИИ соединяются для создания «живых машин». Бактерии, которые очищают почву от тяжелых металлов. Водоросли, которые производят в пять раз больше кислорода. Генетически модифицированные животные для сохранения исчезающих видов. Многое из этого — пока мечта, но научное сообщество серьезно над этим работает.
Через десять лет редактирование генома станет таким же обычным, как программирование компьютеров. Мы будем писать код жизни, чтобы решать любые задачи — от лечения болезней до спасения планеты.
Но все не так просто. Вместе с новыми открытиями появляются новые вопросы. Не повредим ли мы что-то важное? Кто будет нести ответственность за ошибки? И как насчет равного доступа к новым технологиям? Ведь это может углубить неравенство между богатыми и бедными.
Вот почему без открытого обсуждения, четких правил и международного регулирования прогресс рискует стать опасным. Наука и общество должны идти рука об руку, чтобы технологии служили людям, а не становились источником новых проблем.
А ранее мы выяснили — можно ли доверять ИИ, логика которого нам непонятна.






