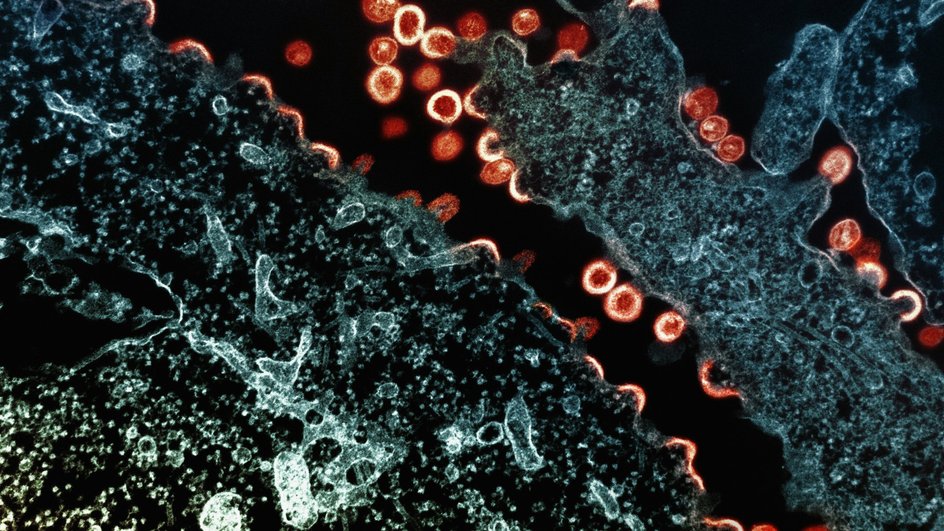
Миграция клеток имеет решающее значение для работы иммунной системы. Клетки‑защитники, например, лейкоциты, должны быстро и гибко перемещаться через разные среды: сначала циркулируя по кровотоку, затем выходя из кровеносных сосудов и самостоятельно продвигаясь через ткани к очагу инфекции, чтобы бороться с вирусами.
Исследователи из университетов Байройта и Гренобля (Германия и Франция) предложили совершенно иной взгляд на миграцию лейкоцитов в своей работе, опубликованной в журнале Physical Review Letters. Они продемонстрировали, что клетки способны перемещаться без участия миозина, молекулярного мотора, обычно считающегося «двигателем» внутри клетки.
По традиционной модели актиновые филаменты, тонкие белковые нити, подпитываемые миозином, сокращаются и формируют ретроградный поток — обратное движение нитей к заднему краю клетки. Этот поток традиционно считался главной движущей силой, однако при подавлении активности миозина лейкоциты продолжали двигаться.
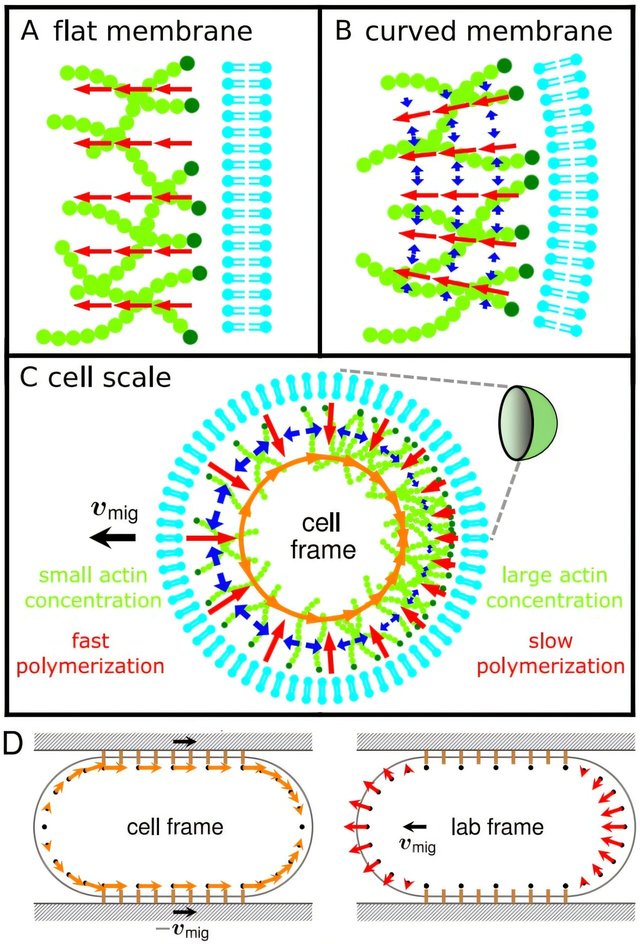
В новой математико‑физической модели ученые учли только полимеризацию актиновых мономеров и их деполимеризацию. При достаточной скорости этих реакций внутри клетки возникает четкая поляризация: в передней части клетка образует менее плотную сеть актиновых нитей, чем в задней.
Разница в натяжении мембраны между «головой» и «хвостом» клетки создает градиент сил: более сильное растяжение у переднего края начинает притягивать актиновые нити из задней части, запуская непрерывный цикл их обновления — тредмиллинг. Именно этот самоподдерживающийся цикл обеспечивает движение клетки вперед без какой‑либо помощи миозина. По словам авторов, открытие может помочь регулировать активность иммунных клеток — от ускорения их реакции при вирусных инфекциях до подавления перемещения опухолевых клеток при метастазировании.
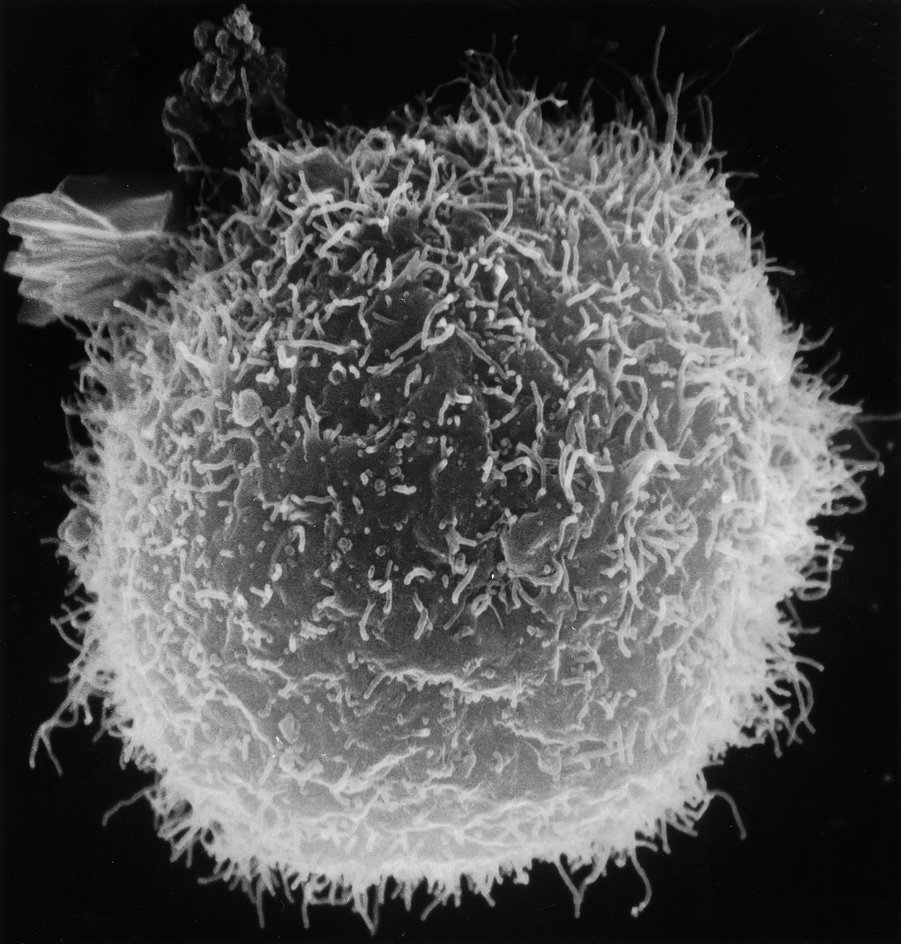
Новое понимание механизмов самоорганизации клеточных компонентов открывает широкие перспективы в биомедицине: от разработки лекарств, регулирующих движение лейкоцитов, до создания терапевтических систем, способных замедлять рост опухолей и защищать здоровые ткани.
Другие ученые тем временем установили, что живые клетки могут ощущать звуковые волны.

