
На данный момент нет лечения, которое могло бы устранить причины появления болезни Пакинсона — гибель нервных клеток в мозге и дефицит дофамина. Точная причина гибели нервных клеток остается неясной. Однако есть признаки того, что за это могут отвечать дефекты в митохондриях.
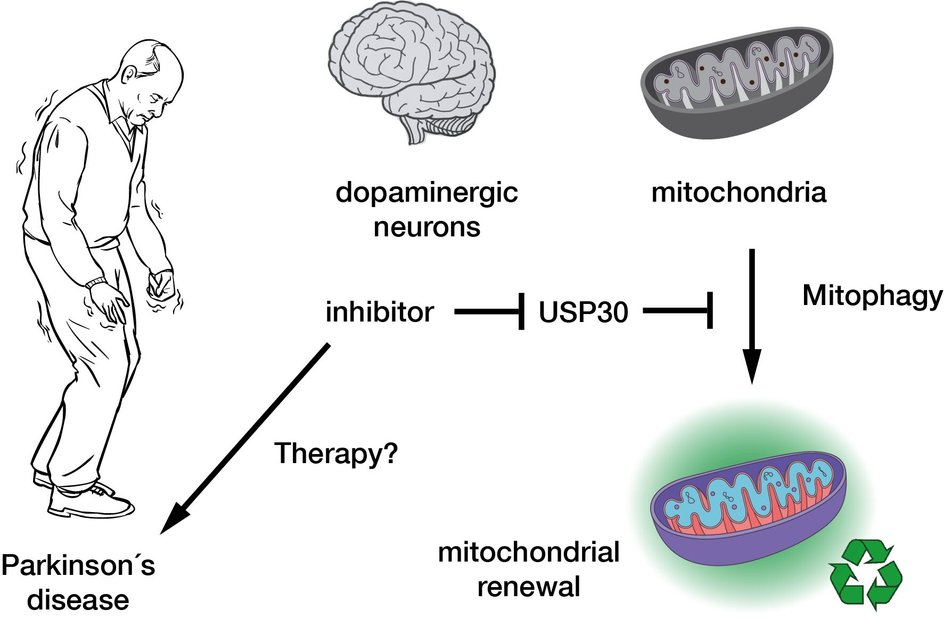
Нервные клетки сильно зависят от митохондрий, поскольку им требуется большое количество энергии. В здоровых клетках митохондрии подвергаются постоянному контролю качества. Если они не выдерживают, их маркирует белок убиквитин, после чего митохондрии уничтожаются. Однако недавно было показано, что неправильная маркировка поврежденных митохондрий предотвращает их гибель (митофагию).
Причиной этого являются некоторые ключевые ферменты митофагии, которые патологически изменены при наследственной форме болезни Паркинсона. Важным ферментом в митофагии является деубиквитиназа USP30 — она удаляет метки убиквитина из дефектных митохондрий. Ингибитор этого фермента, который может способствовать митофагии и, таким образом, улучшать функцию нейронов, в настоящее время проходит клинические испытания, он считается перспективным кандидатом в лекарства для лечения болезни Паркинсона. Однако то, как ингибиторы фактически действуют на USP30, еще не было известно на молекулярном уровне.
Биохимики из Института молекулярной физиологии Общества Макса Планка в Дортмунде расшифровали молекулярный механизм работы перспективного лекарства, сообщает Nature Structural & Molecular Biology. Основная проблема заключалась в том, что сам белок трудно исследовать — он гибкий и неустойчивый, а значит, его сложно «заморозить» в кристалле и получить изображение с помощью рентгеновской кристаллографии — основного метода изучения структуры белков.
Чтобы обойти эту проблему, аспирант Нафизул Кази из команды Герша пошел на оригинальный шаг — он создал химерный белок, объединив фрагменты USP30 с более стабильными частями родственных белков. Получился своеобразный «биомолекулярный Минотавр» — гибрид, достаточно стабильный, чтобы его можно было изучить, но при этом сохраняющий ключевые свойства исходного белка.
Полученные дифракционные изображения показывают, что ингибитор взаимодействует с USP30 двумя способами — он связывается с ранее неизвестной областью, которая открывается только при взаимодействии ингибитора с белком, и в то же время с горячей точкой, которая также доступна для других ингибиторов.
Это открытие объясняет, как работает конкретный механизм, и дает ученым мощный инструмент — новую стратегию белкового дизайна, позволяющую получать стабильные версии трудноизучаемых белков. Такие конструкции могут использоваться и для изучения других ферментов, которые играют важную роль в развитии нейродегенеративных заболеваний, рака или нарушениях иммунной системы.
Ранее мы рассказывали о том, что обнаружен РНК-фермент, способный остановить болезнь Паркинсона.
